前段时间,韩国药企 S&E Biotech 研发的 SNE-101 外泌体药物正式获得韩国食品药品安全部(MFDS)批准,这款装载神经再生 miRNA 的脐带间充质干细胞外泌体,成为韩国首个挺进临床的外泌体疗法,其非人灵长类动物实验展现的修复能力,正通过 1b 期人体试验验证安全性。
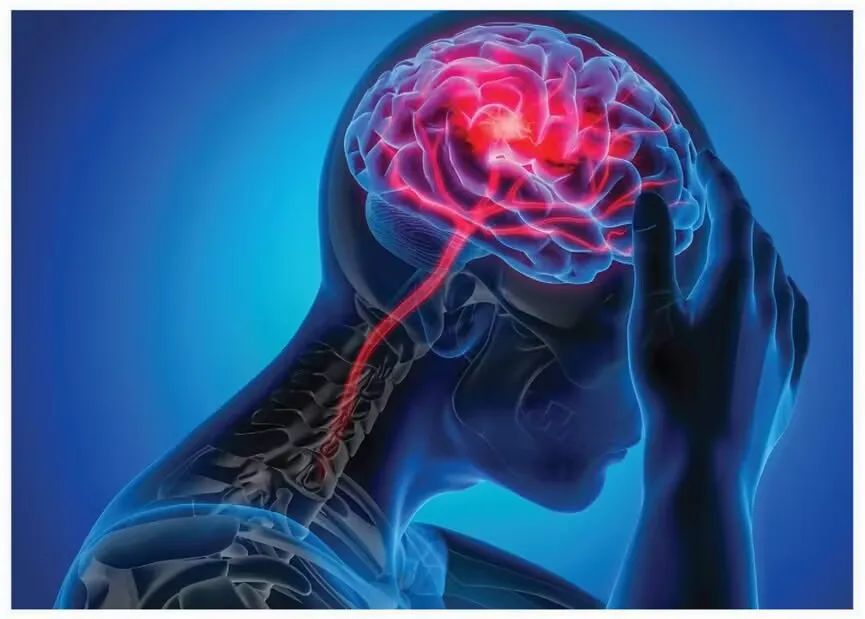
美国 Aruna Bio 全球首个获 FDA 临床批件的神经外泌体疗法 AB126 更显锋芒。这款神经干细胞来源的外泌体通过表面蛋白工程化改造,可精准靶向小脑与基底神经节。2024年1月获批 IND 后,急性缺血性中风患者的 1b/2a 期临床试验已蓄势待发,其携带的天然修复性蛋白有望规避传统细胞治疗风险,在临床前研究中已展现出优异的脑区靶向聚集性和治疗潜力。
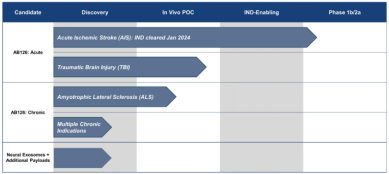
以色列公司 NurExone Biologic 开发的 ExoPTEN 疗法开创非手术治疗先河。该疗法将 siRNA 装载于间充质干细胞外泌体,通过鼻内给药直达损伤部位。2023年临床前数据显示:75%的瘫痪大鼠恢复后肢反射与运动功能。2024年11月 EMA 授予其孤儿药资格,为欧洲快速上市铺平道路——这预示着脊髓损伤患者或将告别手术刀时代。
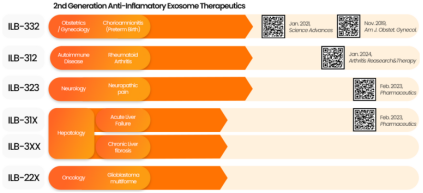
韩国 ILIAS Biologics 的 ILB-202 展现工程化外泌体的精准战力。通过 EXPLOR® 平台递送超抑制因子 IκB(srIκB),该疗法通过递送超抑制因子 IκB(srIκB)靶向抑制 NF-κB 的活性,从而阻断炎症反应。2024年公布的1期健康人试验实现零严重不良事件,且在复杂性区域疼痛综合征(CRPS)动物模型中显著抑制炎症风暴,为自身免疫性疾病提供全新武器库。
礼来12亿美元重注的 DeliverEX™ 平台正改写 RNA 药物命运。该平台通过基因编辑改造外泌体膜蛋白,使其高效穿透血脑屏障,搭载 RNAi 与反义寡核苷酸直抵大脑深处。在奥博资本9500万美元C轮融资加持下,两款未公开的 CNS 候选药物已进入发现阶段,剑指传统疗法无法触及的神经靶点。
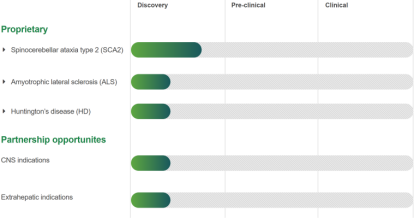
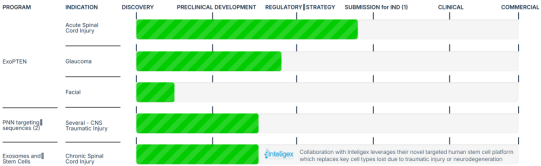
韩国 MDimune Inc. 基于其创新的 BioDrone™ 平台开发的细胞衍生囊泡(CDV) 正在解决外泌体产业化最大痛点。相比传统外泌体,CDV 产能提升10倍且载药效率倍增。2021年与法国 Vect-Horus 合作整合血脑屏障靶向技术后,其针对脑瘤与罕见病的基因疗法已进入临床前攻坚阶段。
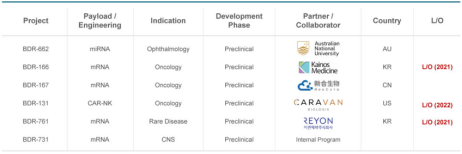
目前外泌体疗法在全球监管层面呈现两种思路:以美欧为代表的“功能监管”划定技术红线;和以日韩为代表的“来源监管”加速临床转化。
1.美国FDA
将外泌体纳入生物药监管,要求符合 PHS 法案严苛标准
2.欧盟双轨制
普通外泌体归为生物制品,而装载功能性 RNA 的外泌体则升级为先进治疗药物(ATMP),监管强度比肩 CAR-T 疗法
3.韩国
通过韩国组织工程与再生医学学会(KTERMS)制定外泌体医美应用指南,助推 SNE-101 快速进入临床
4.日本
将外泌体与传统生物制品等同管理,简化审批流程
据 Global Market Insights 预测,2030年神经疾病外泌体市场规模将突破220亿美元。那些解决标准化生产、攻克长效稳定的企业,将成为千亿赛道最终赢家。此刻,搭载人类智慧的“纳米快递员”正在穿透血脑屏障的最后防线,一场重塑神经疾病治疗史的战役已经打响。
如需了解更多关于“肿瘤”信息
请与我们进一步联系







