全球每分钟有3人因肺癌死亡,其中高达85%的病例属于非小细胞肺癌(NSCLC)。据世界卫生组织最新数据,肺癌位居全球癌症致死率首位。仅2023年,全球新发肺癌病例超220万,死亡病例约180万。其中非小细胞肺癌患者确诊时约75%已处于中晚期,五年生存率不足20%。尽管靶向治疗和免疫疗法带来了希望,但耐药性和低响应率仍是难以逾越的屏障。
引起极大轰动的 CAR-T 免疫细胞疗法,一度改变癌症免疫治疗格局,在多个血液系统恶性肿瘤治疗领域取得了显著成功,让晚期血癌患者中实现了长期生存的奇迹,目前全球已有8款 CAR-T 药物获批上市。
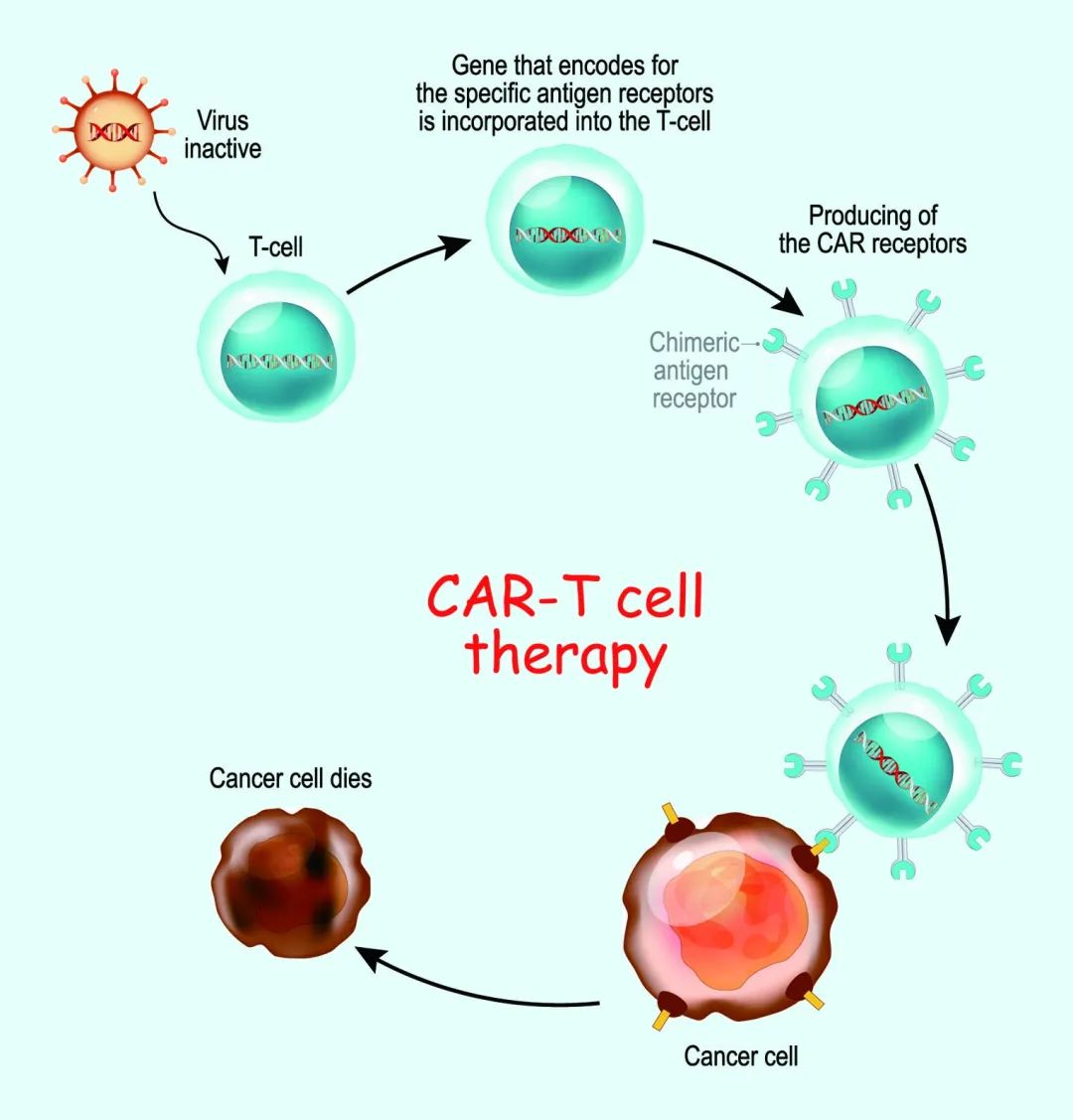
2023年一篇题为“Inhalable CAR-T cell-derived exosomes as paclitaxel carriers for treating lung cancer”的文章报道了一种利用 CAR-T 细胞产生的外泌体(CAR-Exos)递送紫杉醇(PTX)以治疗非小细胞肺癌(NSCLC)的方法。

研究团队通过改造 T 细胞表达靶向间皮素(MSLN)的 CAR 结构,这种在肺癌细胞高表达的抗原成为精准导航的靶标。改造后的 CAR-T 细胞分泌的外泌体,其表面携带 CAR 蛋白构成“归巢信号”,内部则满载着天然杀伤武器——颗粒酶B与穿孔素。这些直径仅100纳米的天然囊泡被证明可高效包裹紫杉醇,载药量达15%(w/w),形成兼具主动靶向与协同杀伤能力的“生物导弹”。
给药方式的创新成为关键转折。 传统静脉注射的外泌体90%会被肝脾截留,而研究团队开创的雾化吸入技术使肺部药物浓度提升40倍。在小鼠模型中,这种吸入式治疗展现出惊人效果:治疗组肿瘤体积缩小至对照组的1/8,生存期从25天延长至60天,组织学检查更显示肺泡结构近乎完全修复。

更令人振奋的是,该疗法展现出双重破冰效应:一方面,CAR-Exos 携带的紫杉醇直接杀伤肿瘤细胞;另一方面,外泌体本身下调 TME中TGF-β、IL-10 等抑制因子达70%,逆转免疫抑制微环境,使肿瘤浸润 CD8+T 细胞数量增加5倍。尤为重要的是,外泌体治疗组完全避免了 CAR-T 疗法常见的细胞因子风暴(CRS),安全性显著提升。

这项技术的战略价值远不止于递送紫杉醇。研究人员指出,CAR-Exos 平台可克服当下 CAR-T 治疗实体瘤的三大核心障碍:突破血肺屏障实现肺部精准递送,穿透致密肿瘤基质,重塑免疫抑制微环境。
在人类对抗肺癌的百年征程中,从开胸手术到靶向药物,从免疫治疗到如今的细胞外囊泡技术,每一次突破都承载着无数生命的期盼。当生物工程与临床医学深度交融,肺癌患者自由呼吸的曙光,或许正蕴藏在这一口承载着亿万个“智能快递”的雾气之中。
如需了解更多关于“肿瘤”信息
请与我们进一步联系







