01.视觉健康危机——眼睛成为“数字时代的牺牲品”
在智能手机、电脑屏幕的包围下,叠加人口老龄化与环境污染,视觉健康危机正悄然蔓延。据相关数据统计,全球约22亿人饱受视力障碍困扰,其中至少10亿人的视力损害本可预防或尚未得到治疗。在中国,干眼症患者突破2.4亿,青光眼、糖尿病视网膜病变等致盲性疾病发病率逐年攀升。人类正在经历一场前所未有的视觉健康危机。

眼部疾病种类繁多,但以下四类尤为突出,其病理机制与治疗困境亟待突破:
01.干眼症:数字时代的“流行病”
现状:中国患者超3亿,全球患病率5%-50%。泪液分泌不足或蒸发过快导致眼表炎症,严重者可致角膜溃疡甚至穿孔。
传统疗法局限:人工泪液仅能暂时湿润眼表,无法修复受损组织;抗炎药物长期使用可能引发眼压升高或继发感染。
02.青光眼:沉默的视力杀手
现状:全球8000万患者,因视网膜神经节细胞(RGCs)不可逆死亡致盲,早期症状隐匿,确诊时往往已丧失40%视神经纤维。
传统疗法局限:降眼压药物或手术仅能延缓病情,无法逆转神经损伤,且部分患者对治疗反应差。
03.糖尿病视网膜病变:高血糖的“眼部代价”
现状:全球1/3糖尿病患者患病,高血糖引发视网膜血管渗漏、增生,最终导致失明。
传统疗法局限:抗VEGF药物需反复眼内注射,患者依从性低,且可能加重黄斑水肿。
04.葡萄膜炎:自身免疫的失控之火
现状:全球年发病率约50/10万,炎症反复发作可致视网膜脱落、永久性视力丧失。
传统疗法局限:糖皮质激素长期使用易诱发白内障、青光眼,免疫抑制剂则增加感染风险。
现有疗法多局限于“治标”,无法解决组织损伤修复、炎症调控与精准给药三大难题。
外泌体(Exosomes)是细胞分泌的纳米级囊泡(30-150nm),携带蛋白质、RNA 等活性物质,堪称细胞间的“通信兵”。它们能精准调控靶细胞功能,促进组织修复、抑制炎症,甚至递送药物。这些特性使其在眼科领域大放异彩,尤其为慢性眼疾提供了全新治疗思路。
01.促进组织修复与再生
角膜损伤或视网膜退变时,外泌体通过传递生长因子(如VEGF、EGF)和调控 miRNA,激活细胞再生。例如,《干细胞研究与治疗》期刊研究显示,间充质干细胞外泌体(MSC-Exos)可使缺血小鼠视网膜厚度恢复至正常水平,效果优于传统神经营养因子。
02.抗炎与免疫调节
外泌体可抑制促炎因子(TNF-α、IL-6),并促进调节性 T 细胞增殖,重塑眼表微环境。在葡萄膜炎动物模型中,外泌体治疗使炎症细胞浸润减少60%,视网膜结构完整性显著提升。
03.抑制术后纤维化
眼科术后瘢痕是视力恢复的“拦路虎”。外泌体通过下调 TGF-β 信号通路,抑制成纤维细胞过度活化,从而减少角膜或视网膜瘢痕形成。
04.精准药物递送
外泌体可作为“天然快递”,装载抗血管生成药物或基因编辑工具(如CRISPR),直达病灶。例如,在糖尿病视网膜病变中,外泌体递送抗 VEGF 药物可精准封闭渗漏血管,避免全身用药的副作用。
而雾化技术更让眼科给药实现历史性跨越。传统眼药水仅5%成分能被吸收,而雾化技术将外泌体分散为1-5nm颗粒,通过眼表雾化直达深层组织。这种非侵入性方式不仅渗透率高,还可避免手术或注射风险,患者依从性大幅提升。

02.临床试验:数据印证疗效,未来可期
01.干眼症:NCT04213248 临床试验(美国国立卫生研究院注册)显示,脐带间充质干细胞外泌体眼药水使用14天后,患者泪液分泌量增加58%,角膜损伤评分降低41%,疗效显著优于人工泪液。
02.角膜修复:日本京都大学团队报道,外泌体雾化治疗使化学烧伤角膜愈合时间缩短50%,新生血管生成减少70%。
03.青光眼:中国科学院动物研究所实验表明,间充质干细胞外泌体眼内注射后,大鼠视网膜神经节细胞存活率提升38%,为神经保护治疗提供新策略。
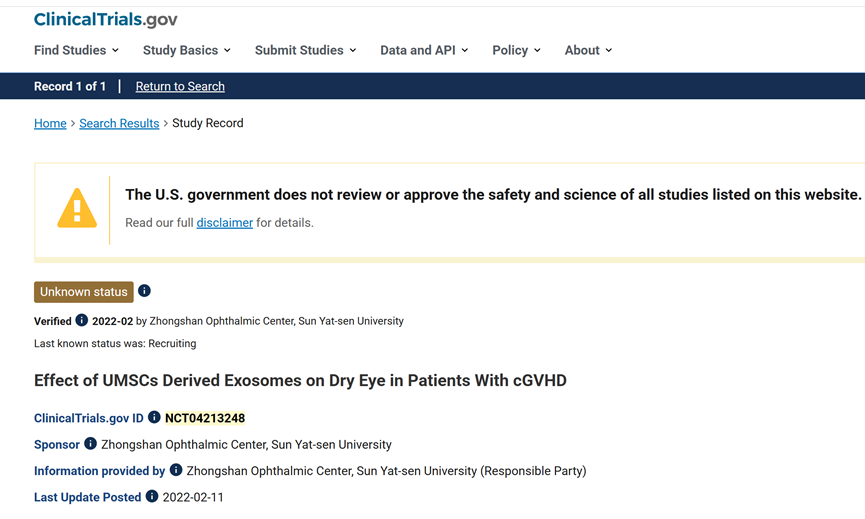
从干眼症的普遍困扰到青光眼的致盲威胁,外泌体技术以其“修复、调控、递送”三位一体的能力,正在重塑眼科治疗范式。未来,随着临床转化加速,这项技术或将彻底改变眼科治疗范式,让更多人重拾“看得见的幸福”。
如需了解更多关于“肿瘤”信息
请与我们进一步联系







